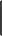(13分)糕点疏松剂的主要成分中有碳酸氢钠。某化学兴趣小组的同(2)
灼热的CuO H2,CO 浓硫酸 H2O
(2)转化法:通过化学反血,将杂质气体转化为所要得到的气体:如除去CO2中的CO,可将混合气体通过足量的灼热CuO+COCu+CO2气体的干燥:
气体的干燥是通过干燥剂来实现的,选择干燥剂要根据气体的性质。一般原则是:酸性干燥剂不能用来干燥碱性气体,碱性干燥剂不能用来干燥酸性气体,干燥装置由干燥剂的状念决定.
(1)常见的干燥剂
干燥剂 可干燥的气体 不可干燥的气体
名称或化学式 酸碱性 状态
浓H2SO4 酸性 液体 H2、N2、O2、CO2、HCl、CH4、CO NH3
固体NaOH、生石灰,碱石灰(氢氧化钠和生石灰的混合物) 碱性 固态 H2、O2、N2、CH4、CO、NH3等 CO2、SO2、HCl
无水CaCl2 中性 固态 除NH3外的所有气体 NH3
(2)干燥装置的选择
①除杂试剂为液体时,常选用洗气瓶,气体一般是 “长进短出”,如下图A。
②除杂试剂为同体时,常选用干燥管(球形或u 形),气体一般是“大进小出”,如下图B、C。
③需要通过加热与固体试剂发生化学反应除去的气体,常采用硬质玻璃管和酒精灯,如下图D。
装置连接顺序的确定规律:
(1)除杂和干燥的先后顺序
①若用洗气装置除杂,一般除杂在前,干燥在后。原因:从溶液中出来的气体通常混有水蒸气,干燥在后可将水蒸气完全除去。如除去CO中混有的CO2和水蒸气,应将气体先通过。NaOH溶液,再通过浓H2SO4。
②若用加热装置除杂,一般是干燥在前,除杂在后。如除去CO2中混有的CO和水蒸气,应将气体先通过浓H2SO4,再通过灼热的CuO。
(2)除去多种杂质气体的顺序一般是先除去酸性较强的气体。如N2中混有 HCl、H2O(气)、O2时,应先除去HCl,再除去水,最后除去O2(用灼热的铜网)。
(3)检验多种气体的先后顺序(一般先验水蒸气):有多种气体需要检验时,应尽量避免前步检验对后步检验的干扰。如被检验的气体中含有CO2和水蒸气时,应先通过无水CuSO4。检验水蒸气,再通过澄清的石灰水检验CO2.
确定气体收集方法的技巧:
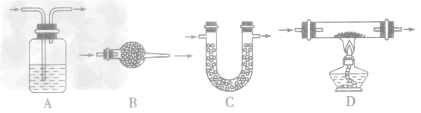
(1)排水集气法适用于“不溶于水且小与水反应的气体”,如下图A。
(2)向上排空气法适用于“密度比空气大且小与空气成分反应的气体”(相对分子质量大于29的气体),如下图B。
(3)向下排空气法适用于“密度比空气小且小与空气成分反应的气体”(相对分子质量小于29的气体),如下图C。

(4)不能用排空气法收集的气体
①气体的密度与空气的密度相近时不能用排空气法收集
②当气体与空气中某一成分反应时不能用排空气法收集
(5)有毒气体收集方法的确定
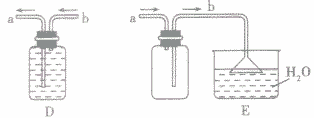
①有毒,但气体难溶于水时,一般采用排水法收集。如下图D
②有毒,但气体叉易溶于水时,则采用带双孔胶塞(一长一短的导气管)的集气瓶利用排空气法收集该气体,但必须接尾气处理装置,以免多余的有毒气体逸散到空气中污染空气,如收集氨气可用图E。
气体制取实验中关于仪器或装置选择题目的解题技巧:
(1)需要研究气体实验室制法的化学反应原理;
(2)需要研究制取这种气体所应采用的实验装置;
(3)需要研究如何证明制得的气体就是要制取的气体。
根据给出的仪器或装置进行选取时,应明确制取气体的发生装置主要是两套(同体加热型和固液常温型),依据反应物的状态和反应条件来确定选用哪套发生装置;气体的收集装置主要就是三套(向上排空气法、向下排空气法和排水法),依据气体的性质来确定选用什么样的收集装置。选择仪器时要注意先对实验原理进行判断,然后再根据原理确定装置所需要的仪器。
考点名称:化学实验数据的分析
实验过程中的各种测量数据及有关现象,应及时准确而清楚地记录下来。记录实验数据时,要有严谨的科学态度,要实事求是,切忌夹杂主观因素,决不能随意拼凑或伪造数据。
常见的易混易错的数据:
1. 托盘天平称量的质量只能精确到小数点后1位。
2. 量筒测量溶液的体积,精确到小数点后1位。
3. 温度计测量的温度数据精确到小数点后1位。
4. pH试纸测量溶液的pH值只能精确到整数位。
考点名称:家庭小实验、趣味实验
“家庭小实验”是指利用家庭生活用品来进行化学实验,从而对化学进行学习和探讨的活动。它具有趣味性、探究性、规范性、普及性等特点。
常见的家庭小实验:
(1)
序号 1
实验名称 点不着的“纸”
家庭用到的实验器材及药品 铜棒两张相同的长条白纸火柴
实验步骤
1、用火柴直接点其中的一张纸条;
2、将另一张纸条先以螺旋形紧紧地缠绕在铜棒上,再去点燃;
实验现象 1、纸条迅速燃烧 2、纸条没有燃烧
实验结论 因为铜具有良好的导热性,将加热处的热量迅速传导散失,使其温度达不到纸条的着火点而点不着。
注意事项 铜棒是金属,有良好的导热性,注意勿烫手。
(2)
序号 2
实验名称 “神奇”的手帕
家庭用到的实验器材及药品 酒精的水溶液(1:1)棉手帕钳子(两只)火柴
实验步骤 把棉手帕放入用酒精与水以1:1配成的溶液里浸透,然后轻挤,用两只钳子分别夹住手帕两角,放到火上点燃,等火焰减小时迅速摇动手帕,使火焰熄灭。
实验现象 手帕依旧完好如初。
实验结论 燃烧时,酒精的火焰在水层外,吸附在纤维空隙里的水分吸收燃烧放出的热量而蒸发,手帕上的温度达不到纤维的着火点,因而手帕烧不坏。
注意事项 由于火焰温度较高,注意别烧伤手及对着其他人,且远离其它可燃物。
(3)
序号 3
实验名称 金属性质“谁更强”
家庭用到的实验器材及药品 白醋、铝片、铁片、铜片、剪刀、砂纸、玻璃杯
实验步骤
1、用三个小玻璃杯各取适量白醋,用砂纸把三种金属打磨光亮,再用剪刀剪三种金属少量分别加入白醋中;
2、用剪过剩下的铝片放入放铁的杯子中,充分振荡;
实验现象
1、放铝和铁的杯子中产生气泡,放铜的杯子中没有,且放铁的杯子中溶液颜色变为浅绿色;
2、铝片表面出现灰黑色固体,且溶液颜色由浅绿色变为无色;
实验结论
1、铝和铁的活动性都比铜强;
2、铝的活动性大于铁;所以:铝>铁>铜
注意事项 观察颜色的变化要仔细呦!
(4)
序号 4
实验名称 自制碳酸饮料
家庭用到的实验器材及药品 凉开水250克、柠檬汁1.5克、白糖8克、小苏打(NaHCO3)1.5克、500ml饮料瓶、适量果汁